Extracorporale membraanoxygenatie
Opgegeven reden: Dit artikel is een computervertaling, en vereist nog enkele nazorg. Ook missen er interne linkjes.
Extracorporale membraanoxygenatie (ECMO), ook bekend als extracorporale levensondersteuning (ECLS), is een extracorporale techniek om langdurige ondersteuning van hart en longen te bieden aan personen van wie hart en longen niet in staat zijn voldoende gasuitwisseling of perfusie te leveren om in leven te blijven. De technologie voor ECMO is grotendeels afgeleid van cardiopulmonaire bypass, die ondersteuning op kortere termijn biedt met gestopte eigen circulatie. Het gebruikte apparaat is een membraanoxygenator, ook wel kunstlong genoemd.
ECMO werkt door tijdelijk bloed aan het lichaam te onttrekken om kunstmatige oxygenatie van de rode bloedcellen en verwijdering van kooldioxide mogelijk te maken. In het algemeen wordt het gebruikt na een cardiopulmonaire bypass of in een laat stadium bij de behandeling van iemand met ernstig hart- en/of longfalen, hoewel het nu in bepaalde centra wordt gebruikt als behandeling voor een hartstilstand, waardoor de onderliggende oorzaak van de stilstand kan worden behandeld terwijl de circulatie en oxygenatie worden ondersteund. ECMO wordt ook gebruikt ter ondersteuning van patiënten met de acute virale longontsteking geassocieerd met COVID-19 in gevallen waar kunstmatige beademing niet voldoende is om de bloedzuurstofvoorziening op peil te houden.
Medische toepassingen[bewerken]
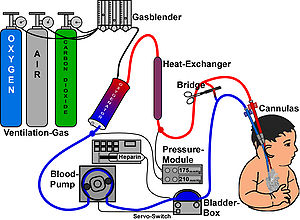
Richtlijnen die de indicaties en de praktijk van ECMO beschrijven zijn gepubliceerd door de Extracorporeal Life Support Organization (ELSO). Criteria voor het initiëren van ECMO variëren per instelling, maar omvatten over het algemeen acuut ernstig hart- of longfalen dat mogelijk omkeerbaar is en niet reageert op conventionele behandeling. Voorbeelden van klinische situaties die aanleiding kunnen geven tot het initiëren van ECMO zijn de volgende:[1]
- Hypoxemisch respiratoir falen met een verhouding tussen arteriële zuurstofspanning en fractie geïnspireerde zuurstof (PaO2/FiO2) van <100 mmHg ondanks optimalisatie van de ventilatorinstellingen, waaronder de fractie geïnspireerde zuurstof (FiO2), positieve end-expiratoire druk (PEEP), en inspiratoire/expiratoire (I:E) verhouding.
- Hypercapnisch ademhalingsfalen met een arteriële pH <7,20
- Refractaire cardiogene shock
- Hartstilstand
- Het niet kunnen loslaten van cardiopulmonaire bypass na een hartoperatie
- Als overbrugging naar harttransplantatie of plaatsing van een ventriculair assistentieapparaat
- Als overbrugging naar longtransplantatie
- Septische shock is een meer controversiële maar in toenemende mate bestudeerde toepassing van ECMO.
- Hypothermie, met een kerntemperatuur tussen 28 en 24 °C en hartinstabiliteit, of met een kerntemperatuur lager dan 24 °C.[2]
Bij mensen met een hartstilstand of cardiogene shock lijkt het de overleving en goede uitkomsten te verbeteren..[3]
Gebruik bij COVID-19 patiënten[bewerken]
Sinds begin februari 2020 gebruiken artsen in China in toenemende mate ECMO als aanvullende ondersteuning voor patiënten die zich presenteren met een acute virale longontsteking geassocieerd met SARS-CoV-2-infectie (COVID-19) wanneer, zelfs na beademing, het zuurstofgehalte in het bloed te laag blijft om de patiënt in leven te houden.[4] Uit de eerste rapporten blijkt dat het bijdraagt tot het herstel van de zuurstofverzadiging in het bloed van de patiënt en tot een vermindering van het aantal sterfgevallen in de ongeveer 3% van de ernstige gevallen waarin het werd gebruikt.[5] Bij ernstig zieke patiënten daalt het sterftecijfer van ongeveer 59-71% met conventionele therapie tot ongeveer 46% met extracorporale membraanoxygenatie. Een artikel in de Los Angeles Times van maart 2021 illustreerde de doeltreffendheid van ECMO bij een extreem moeilijke COVID-patiënt.[6]
Uitkomsten[bewerken]
Vroege studies hadden een overlevingsvoordeel aangetoond bij het gebruik van ECMO voor mensen met acute ademhalingsmoeilijkheden, vooral in de setting van acuut respiratoir distress syndroom. Een door ELSO bijgehouden register van bijna 51.000 mensen die ECMO hebben ontvangen, heeft resultaten gemeld met 75% overleving voor neonataal ademhalingsfalen, 56% overleving voor pediatrisch ademhalingsfalen, en 55% overleving voor volwassen ademhalingsfalen. Andere observationele en ongecontroleerde klinische onderzoeken hebben overlevingspercentages van 50 tot 70% gerapporteerd. Deze gerapporteerde overlevingspercentages zijn beter dan de historische overlevingspercentages. Hoewel ECMO wordt gebruikt voor een reeks aandoeningen met uiteenlopende sterftecijfers, is vroegtijdige opsporing essentieel om de progressie van de verslechtering te voorkomen en de overlevingsresultaten te verbeteren.[7]
In het Verenigd Koninkrijk is het gebruik van veno-veneuze ECMO geconcentreerd in aangewezen ECMO-centra om de zorg mogelijk te verbeteren en betere resultaten te bevorderen.
Contra-indicaties[bewerken]
De meeste contra-indicaties zijn relatief, waarbij de risico's van de procedure worden afgewogen tegen de mogelijke voordelen. De relatieve contra-indicaties zijn:
- Voorwaarden die onverenigbaar zijn met het normale leven als de persoon herstelt
- Reeds bestaande aandoeningen die de kwaliteit van leven beïnvloeden (CNS status, eindstadium maligniteit, risico van systemische bloedingen met anticoagulatie)
- Leeftijd en grootte
- Futiliteit: degenen die te ziek zijn, te lang conventionele therapie hebben gehad of een fatale diagnose hebben.
Bijwerkingen/Complicaties[bewerken]
Neurologisch[bewerken]
Een veel voorkomend gevolg bij met ECMO behandelde volwassenen is neurologisch letsel, waaronder intracerebrale bloeding, subarachnoïdale bloeding, ischemische infarcten in vatbare delen van de hersenen, hypoxisch-ischemische encefalopathie, onverklaarbare coma en hersendood. Bloedingen komen voor bij 30 tot 40% van degenen die ECMO krijgen en kunnen levensbedreigend zijn. Dit is zowel te wijten aan de noodzakelijke continue heparine-infusie als aan de disfunctie van de bloedplaatjes. Een zorgvuldige operatietechniek, een bloedplaatjesaantal van meer dan 100.000/mm3 en het aanhouden van de beoogde geactiveerde stollingstijd verminderen de kans op bloedingen.
Bloed[bewerken]
Door heparine geïnduceerde trombocytopenie (HIT) komt steeds vaker voor bij mensen die ECMO krijgen. Wanneer HIT wordt vermoed, wordt de heparine-infusie gewoonlijk vervangen door een niet-heparine anticoagulans.
Er is een retrograde bloedstroom in de neergaande aorta wanneer de femorale slagader en ader worden gebruikt voor VA (Veno-Arteriële) ECMO. Stasis van het bloed kan optreden als de output van de linkerventrikel niet op peil wordt gehouden, wat trombose tot gevolg kan hebben.
Brug naar assistent-apparaat[bewerken]
Bij VA ECMO kunnen personen van wie de hartfunctie niet voldoende herstelt om van ECMO te worden gesaneerd, worden overbrugd naar een ventriculair assistent-apparaat (VAD) of transplantatie. Tijdens de cannulatie kunnen verschillende complicaties optreden, waaronder vaatperforatie met bloeding, arteriële dissectie, distale ischemie en onjuiste locatie (bv. veneuze canule geplaatst in de slagader), maar deze gebeurtenissen komen zeer zelden voor.
Kinderen[bewerken]
Prematuren lopen een onaanvaardbaar hoog risico op een intraventriculaire bloeding (IVH) indien zij ECMO krijgen toegediend bij een zwangerschapsduur van minder dan 32 weken.[8]
Infecties[bewerken]
De prevalentie van ziekenhuisinfecties tijdens ECMO is 10-12% (hoger in vergelijking met andere kritisch zieke patiënten). Coagulase-negatieve stafylokokken, Candida spp., Enterobacteriaceae en Pseudomonas aeruginosa zijn de meest betrokken pathogenen. ECMO-patiënten vertonen een hoge incidentie van ventilatiegeassocieerde pneumonie (24,4 gevallen/1000 ECMO-dagen), waarbij Enterobacteriaceae een belangrijke rol spelen. Het infectierisico bleek toe te nemen met de duur van de ECMO run, wat de belangrijkste risicofactor is voor de ontwikkeling van infecties. Andere ECMO-specifieke factoren die tot infecties kunnen leiden, zijn de ernst van de ziekte bij ECMO-patiënten, het hoge risico van bacteriële translocatie vanuit de darm en ECMO-gerelateerde aantasting van het immuunsysteem. Een andere belangrijke kwestie is de microbiële kolonisatie van katheters, ECMO-canules en de oxygenator.[9]
Soorten[bewerken]
Er zijn verschillende vormen van ECMO; de twee meest voorkomende zijn veno-arteriële (VA) ECMO en veno-veneuze (VV) ECMO. Bij beide modaliteiten wordt bloed uit het veneuze systeem afgevoerd en buiten het lichaam van zuurstof voorzien. Bij VA ECMO wordt dit bloed teruggevoerd naar het arteriële systeem en bij VV ECMO wordt het bloed teruggevoerd naar het veneuze systeem. Bij VV ECMO wordt geen hartondersteuning gegeven.
Veno-arterieel[bewerken]
Bij veneo-arteriële (VA) ECMO wordt gewoonlijk een veneuze canule in de rechter- of linkerdijbeenslagader geplaatst voor extractie, en een arteriële canule in de rechter- of linkerdijbeenslagader voor infusie. De punt van de veneuze canule in het femur moet in de buurt van de kruising van de vena cava inferior en de rechteratrium worden gehouden, terwijl de punt van de arteriële canule in het femur in de arteria iliaca wordt gehouden. Bij volwassenen wordt de voorkeur gegeven aan toegang tot de femorale slagader omdat het inbrengen eenvoudiger is. Centrale VA ECMO kan worden gebruikt als er al een cardiopulmonaire bypass is aangelegd of als er een noodre-sternotomie is uitgevoerd (met canules in de rechterboezem (of SVC/IVC voor tricuspidalisherstel) en ascenderende aorta).
VA ECMO wordt gewoonlijk gereserveerd wanneer de eigen hartfunctie minimaal is om de verhoogde slagarbeid van het hart te matigen die gepaard gaat met pompen tegen de retrograde stroom die door de aortacanule wordt geleverd.
Veno-veneuze[bewerken]
Bij veno-veneuze (VV) ECMO worden gewoonlijk canules in de rechter gemeenschappelijke femorale vene geplaatst voor drainage en in de rechter interne halsader voor infusie. Als alternatief wordt een tweelumen katheter in de rechter inwendige halsader ingebracht, waardoor het bloed uit de bovenste en onderste vena cavae wordt afgevoerd en naar de rechterboezem wordt teruggevoerd.
Initiëring[bewerken]
ECMO mag alleen worden uitgevoerd door clinici met opleiding en ervaring in het inbrengen, onderhouden en afbreken ervan. ECMO wordt meestal in de operatiekamer ingebracht door een cardiothoracaal chirurg. ECMO-beheer wordt gewoonlijk uitgevoerd door een gediplomeerd verpleegkundige, een ademhalingstherapeut of een perfusionist. Als besloten is om ECMO te starten, wordt de patiënt geanticoaguleerd met intraveneuze heparine om trombusvorming door stolling van de oxygenator te voorkomen. Voorafgaand aan de start wordt een IV bolus heparine toegediend en gemeten om te verzekeren dat de geactiveerde stollingstijd (ACT) tussen 300 en 350 seconden ligt. Zodra de ACT tussen dit bereik ligt, kan de ECMO worden gestart en wordt daarna een heparine-infuus gestart als onderhoudsdosis.[10]
Cannulatie[bewerken]
Canules kunnen percutaan worden geplaatst met de Seldinger-techniek, een relatief eenvoudige en gangbare methode om toegang tot bloedvaten te krijgen, of via chirurgische insnijding. De grootste canules die in de vaten kunnen worden geplaatst, worden gebruikt om de doorstroming te maximaliseren en de afschuifspanning te minimaliseren.
ECMO die nodig is voor complicaties na een hartoperatie kan rechtstreeks in de juiste kamers van het hart of de grote vaten worden geplaatst. Centrale cannulatie via laterale thoracotomie stelt patiënten in afwachting van longtransplantatie in staat om ongesedeerd en ambulant te blijven.[11]
Titratie[bewerken]
Na de canule en de aansluiting op het ECMO-circuit wordt aan de hand van hemodynamische parameters en lichamelijk onderzoek de juiste hoeveelheid bloedstroom door het ECMO-circuit bepaald. Het doel van het in stand houden van de eindorgaanperfusie via het ECMO-circuit wordt afgewogen tegen voldoende fysiologische bloedstroom door het hart om stasis en de daaropvolgende vorming van bloedstolsels te voorkomen.
Onderhoud[bewerken]
Zodra de aanvankelijke respiratoire en hemodynamische doelstellingen zijn bereikt, wordt de bloedstroom op die snelheid gehandhaafd. Frequente evaluatie en aanpassingen worden vergemakkelijkt door continue veneuze oximetrie, die rechtstreeks de oxyhemoglobine saturatie van het bloed in het veneuze deel van het ECMO circuit meet.
Speciale overwegingen[bewerken]
VV ECMO wordt meestal gebruikt bij ademhalingsproblemen, terwijl VA ECMO wordt gebruikt bij hartproblemen. Er zijn unieke overwegingen voor elk type ECMO, die het beheer beïnvloeden.
Bloedstroom[bewerken]
Bij VV ECMO zijn bijna-maximale stroomsnelheden meestal gewenst om de zuurstoftoediening te optimaliseren. Bij VA ECMO daarentegen moet de stroomsnelheid hoog genoeg zijn om een adequate perfusiedruk en veneuze oxyhemoglobinesaturatie (gemeten op drainagebloed) te verkrijgen, maar laag genoeg om voldoende preload te verkrijgen om de linker ventriculaire output te behouden.
Diurese[bewerken]
Aangezien de meeste mensen overbelast zijn wanneer ECMO wordt gestart, is agressieve diurese gerechtvaardigd zodra de patiënt stabiel is op ECMO. Ultrafiltratie kan gemakkelijk aan het ECMO-circuit worden toegevoegd als de patiënt onvoldoende urineproductie heeft. ECMO-"geratel", of instabiliteit van ECMO-golfvormen, duidt op onderreanimatie en zou het staken van agressieve diurese of ultrafiltratie rechtvaardigen.
Linkerventrikelmonitoring[bewerken]
De linkerventrikeloutput wordt streng gecontroleerd tijdens VA ECMO omdat de linkerventrikelfunctie kan worden aangetast door een verhoogde afterload, wat op zijn beurt kan leiden tot trombusvorming in het hart.
Afwennen en stoppen[bewerken]
Bij mensen met ademhalingsmoeilijkheden wijzen verbeteringen in de radiografische weergave, pulmonale compliance en arteriële oxyhemoglobinesaturatie erop dat de persoon klaar kan zijn om van de ECMO-ondersteuning te worden gehaald. Voor mensen met hartfalen hangt een verbeterde aortapulsatiliteit samen met een verbeterde output van de linkerventrikel en kan dit erop wijzen dat zij klaar zijn om van ECMO-ondersteuning te worden afgehaald. Als alle markers in goede staat zijn, worden de bloedstromen op de ECMO langzaam verlaagd en worden de parameters van de patiënt gedurende die tijd geobserveerd om te garanderen dat de patiënt de veranderingen kan verdragen. Wanneer de flow onder de 2 liter per minuut is, wordt geprobeerd de ECMO definitief te verwijderen en de patiënt wordt gedurende deze tijd verder gemonitord totdat de canules kunnen worden verwijderd.
Veno-veneuze ECMO bevrijdingsproef[bewerken]
VV ECMO proeven worden uitgevoerd door het elimineren van alle tegenstroom sweep gas door de oxygenator. De extracorporale bloedstroom blijft constant, maar de gasoverdracht vindt niet plaats. Zij worden dan gedurende verscheidene uren geobserveerd, waarbij de ventilatorinstellingen die nodig zijn om adequate oxygenatie en beademing zonder ECMO te handhaven, worden bepaald aan de hand van arteriële en veneuze bloedgasresultaten.
Veno-arteriële ECMO bevrijdingstest[bewerken]
Bij VA ECMO-proeven moeten zowel de drainage- als de infuuslijnen tijdelijk worden afgeklemd, terwijl het ECMO-circuit via een brug tussen de arteriële en veneuze ledematen kan circuleren. Dit voorkomt trombose van stagnerend bloed in het ECMO-circuit. Bovendien moeten de arteriële en veneuze lijnen continu worden gespoeld met gehepariniseerde zoutoplossing of intermitterend met gehepariniseerd bloed uit het circuit. In het algemeen duren VA ECMO-proeven korter dan VV ECMO-proeven vanwege het hogere risico op trombusvorming.
Geschiedenis[bewerken]
ECMO werd in de jaren 1950 ontwikkeld door John Gibbon, en vervolgens door C. Walton Lillehei. De eerste toepassing voor neonaten was in 1965.[12][13]
Banning Gray[14] Lary toonde voor het eerst aan dat intraveneuze zuurstof het leven in stand kon houden. Zijn resultaten werden gepubliceerd in Surgical Forum in november 1951.[15] Lary gaf commentaar op zijn eerste werk in een presentatie uit 2007 waarin hij schrijft: "Ons onderzoek begon met het in elkaar zetten van een apparaat dat voor het eerst dieren in leven hield terwijl zij zuivere stikstof ademden. Dit werd bereikt met zeer kleine belletjes zuurstof die in de bloedstroom werden geïnjecteerd. Deze belletjes werden gemaakt door een "bevochtigingsmiddel" toe te voegen aan zuurstof die door een porseleinen filter in de veneuze bloedstroom werd geperst. Kort na de eerste presentatie aan het American College of Surgeons werd dit apparaat herzien door Walton Lillehei, die samen met DeWall de eerste praktische hart-longmachine maakte die gebruik maakte van een zuurstofbelletjesmachine. Met variaties werden dergelijke machines gedurende de volgende twintig jaar gebruikt."
Onderzoek[bewerken]
Een onderzoek uit 2014 toonde aan dat een factor XIIa remmend antilichaam tromboprotectie biedt bij extracorporale circulatie zonder dat het bloedingsrisico toeneemt. Experimenten op neonatale dieren toonden aan dat ECMO-behandeling kan leiden tot apoptose van enterocyten, beschadiging van de darmslijmvliesbarrière en bacteriële translocatie. Dit zou een verklaring kunnen zijn voor de ernst van het systemisch inflammatoir reactiesyndroom bij pasgeborenen. ECMO is ook gebruikt op kadavers omdat het de levensvatbaarheid van getransplanteerde organen kan verhogen.
Zie ook[bewerken]
Externe link[bewerken]
- American Thoracic Society, Patient Education: What is ECMO? (Online-PDF)
Bronnen, noten en/of referenties
|
| Zie de categorie Extracorporeal membrane oxygenation van Wikimedia Commons voor mediabestanden over dit onderwerp. |
| Coronavirussen | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
| Geografische verspreiding SARS-CoV-2 (niet alle landen waarin het virus is uitgebroken zijn opgenomen) | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Dit artikel "Extracorporale membraanoxygenatie" is uit Wikipedia. De lijst van zijn auteurs is te zien in zijn historische en/of op de pagina Edithistory:Extracorporale membraanoxygenatie.
